- ผู้เขียน Jason Gerald [email protected].
- Public 2023-12-16 11:42.
- แก้ไขล่าสุด 2025-06-01 06:08.
การเจือจางเป็นกระบวนการทำให้สารละลายเข้มข้นเจือจางมากขึ้น มีสาเหตุหลายประการที่ทำให้บางคนอาจต้องการเจือจาง ตั้งแต่เหตุผลที่จริงจังไปจนถึงเหตุผลง่ายๆ ตัวอย่างเช่น นักชีวเคมีเจือจางสารละลายจากรูปแบบเข้มข้นเพื่อสร้างสารละลายใหม่สำหรับใช้ในการทดลอง ในขณะที่บาร์เทนเดอร์มักจะเจือจางสุราด้วยน้ำอัดลมหรือน้ำผลไม้เพื่อให้ค็อกเทลมีรสชาติดีขึ้น สูตรทั่วไปในการคำนวณการเจือจางคือ ค1วี1 = C2วี2, กับ C1 และ C2 แทนความเข้มข้นเริ่มต้นและสุดท้ายของสารละลายตามลำดับ และ V1 และ V2 แสดงถึงปริมาณ
ขั้นตอน
วิธีที่ 1 จาก 2: การเจือจางสารเข้มข้นอย่างแม่นยำโดยใช้สมการการเจือจาง

ขั้นตอนที่ 1. กำหนดสิ่งที่คุณรู้และไม่รู้
การเจือจางทางเคมีมักจะหมายถึงการใช้สารละลายจำนวนเล็กน้อยซึ่งคุณรู้ความเข้มข้น จากนั้นจึงเติมของเหลวที่เป็นกลาง (เช่น น้ำ) เพื่อสร้างสารละลายใหม่ที่มีปริมาตรมากขึ้นแต่มีความเข้มข้นต่ำกว่า สิ่งนี้ทำบ่อยมากในห้องปฏิบัติการเคมี เพราะเพื่อประสิทธิผล รีเอเจนต์มักถูกจัดเก็บไว้ที่ความเข้มข้นสูงมาก ซึ่งจะเจือจางเพื่อใช้ในการทดลอง โดยปกติ ในสถานการณ์จริงส่วนใหญ่ คุณจะรู้ความเข้มข้นของสารละลายตั้งต้นและความเข้มข้นหรือปริมาตรที่คุณต้องการให้ความเข้มข้นสุดท้ายเป็น แต่ไม่ใช่ปริมาตรของสารละลายตั้งต้นที่คุณต้องการเพื่อให้ได้สารละลายสุดท้าย
- อย่างไรก็ตาม ในสถานการณ์อื่นๆ (โดยเฉพาะในปัญหาในโรงเรียน) คุณอาจจำเป็นต้องค้นหาส่วนอื่นๆ ของปริศนา เช่น คุณอาจได้รับปริมาตรและความเข้มข้นเริ่มต้น จากนั้นให้ค้นหาความเข้มข้นสุดท้ายหากคุณเจือจางสารละลาย ตาม ให้ได้ปริมาณที่ต้องการ ในกรณีของการเจือจาง คุณควรสังเกตตัวแปรที่รู้จักและไม่รู้จักก่อนเริ่มต้น
-
มาจบคำถามตัวอย่างกัน สมมติว่าเราถูกขอให้เจือจางสารละลาย 5 M กับน้ำเพื่อให้ได้ 1 L ของ 1. สารละลาย mM. ในกรณีนี้ เราทราบความเข้มข้นของสารละลายตั้งต้นและปริมาตรและความเข้มข้นสุดท้ายที่เราต้องการ แต่ไม่ใช่ปริมาณของสารละลายตั้งต้นที่เราจำเป็นต้องเติมด้วยน้ำเพื่อให้ได้ผลลัพธ์ตามที่ต้องการ
ข้อควรจำ: ในวิชาเคมี M คือการวัดความเข้มข้นที่เรียกว่า โมลาริตี ซึ่งหมายถึงโมลของสารต่อลิตร
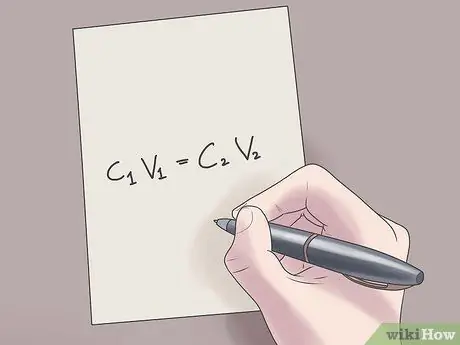
ขั้นตอนที่ 2 เสียบค่าของคุณลงในสูตร C1วี1 = C2วี2.
ในสูตรนี้ C1 คือความเข้มข้นเริ่มต้นของสารละลาย V1 คือปริมาตรของสารละลายตั้งต้น C2 คือความเข้มข้นสุดท้ายของสารละลาย และ V2 คือปริมาตรของสารละลายสุดท้าย การใส่ค่าที่รู้จักลงในสมการนี้จะช่วยให้คุณค้นหาค่าที่ไม่รู้จักได้โดยยากน้อยลง
- คุณอาจพบว่าการใส่เครื่องหมายคำถามไว้หน้าหน่วยการเรียนรู้ที่คุณต้องการค้นหาสามารถช่วยแก้ปัญหาได้
-
มาดูตัวอย่างของเรากันต่อ เราจะป้อนค่าที่เรารู้ดังนี้:
- ค1วี1 = C2วี2
- (5 M)V1 = (1 มิลลิโมลาร์) (1 ลิตร) ความเข้มข้นทั้งสองของเรามีหน่วยต่างกัน หยุดที่นี่และไปยังขั้นตอนต่อไป

ขั้นตอนที่ 3 พิจารณาความแตกต่างของหน่วย
เนื่องจากการแก้ปัญหาเกี่ยวข้องกับการเปลี่ยนแปลงความเข้มข้น (ซึ่งบางครั้งอาจมีขนาดค่อนข้างใหญ่) จึงไม่แปลกที่ตัวแปรทั้งสองในสมการของคุณจะมีหน่วยต่างกัน แม้ว่าสิ่งนี้จะมองข้ามได้ง่าย แต่หน่วยที่ไม่เท่ากันในสมการของคุณอาจทำให้คำตอบของคุณไม่ถูกต้อง ก่อนเสร็จสิ้นให้แปลงค่าทั้งหมดด้วยหน่วยความเข้มข้นและ/หรือปริมาตรต่างกัน
-
ในตัวอย่างของเรา เราใช้หน่วยต่าง ๆ สำหรับความเข้มข้นของ M (ฟันกราม) และ mM (มิลลิโมลาร์) ลองเปลี่ยนการวัดที่สองของเราเป็น M:
- 1 mM × 1 M/1,000 mM
- = 0.001 M

ขั้นตอนที่ 4. เสร็จสิ้น
เมื่อทุกหน่วยเท่ากัน ให้แก้สมการของคุณ ซึ่งทำได้เกือบทุกครั้งด้วยพีชคณิตง่ายๆ
-
เราหยุดตัวอย่างปัญหาที่นี่: (5 M)V1 = (1 มิลลิโมลาร์)(1 ลิตร) มาหาค่า V. กัน1 กับยูนิตใหม่ของเรา
- (5 M)V1 = (0.001 ล้าน) (1 ลิตร)
- วี1 = (0.001 ล้าน)(1 ลิตร)/(5 ล้าน)
-
วี1 = 0.0002 ลิตร หรือ 0.2 มล.

ขั้นตอนที่ 5. ทำความเข้าใจวิธีการใช้คำตอบของคุณอย่างถูกต้อง
สมมติว่าคุณพบค่าที่หายไปแล้ว แต่คุณไม่แน่ใจว่าจะใช้ข้อมูลใหม่นี้ในการเจือจางจริงอย่างไรที่คุณต้องทำ เป็นเรื่องที่เข้าใจได้ - ภาษาของคณิตศาสตร์และวิทยาศาสตร์บางครั้งไม่ตรงกับโลกแห่งความเป็นจริง เมื่อคุณทราบค่าสี่ค่าในสมการ C1วี1 = C2วี2ทำการเจือจางดังนี้:
- วัดปริมาตร V1 จากสารละลายที่มีความเข้มข้น C1. จากนั้นเติมสารเจือจางที่เพียงพอ (น้ำ ฯลฯ) เพื่อให้ปริมาตรรวม V2. สารละลายใหม่นี้จะมีความเข้มข้นที่คุณต้องการ (C2).
- ในตัวอย่างของเรา อันดับแรก เราจะวัด 0.2 mL ของสารละลาย 5 M จากนั้นเราจะเติมน้ำให้เพียงพอเพื่อเพิ่มปริมาตรของสารละลายเป็น 1 L: 1 L - 0.0002 L = 0.9998 L หรือ 999, 8 mL. กล่าวคือ เราจะเติมน้ำ 999.8 มล. ลงในสารละลายตัวอย่างเล็กๆ ของเรา สารละลายเจือจางแบบใหม่ของเรามีความเข้มข้น 1 มิลลิโมลาร์ ซึ่งเป็นความเข้มข้นที่เราต้องการ
วิธีที่ 2 จาก 2: การสร้างโซลูชันการเจือจางที่ง่ายและใช้งานได้จริง

ขั้นตอนที่ 1 อ่านบรรจุภัณฑ์เพื่อดูข้อมูล
มีสาเหตุหลายประการที่คุณอาจต้องการทำสารละลายเจือจางที่บ้าน ในห้องครัว หรือในห้องปฏิบัติการอื่นที่ไม่ใช่สารเคมี ตัวอย่างเช่น การทำน้ำส้มจากน้ำส้มคั้นแบบธรรมดาเป็นการเจือจาง ในหลายกรณี ผลิตภัณฑ์ที่ต้องเจือจางมีข้อมูลเกี่ยวกับการเจือจางที่ต้องทำ ซึ่งอยู่ที่ใดที่หนึ่งบนบรรจุภัณฑ์ พวกเขาอาจมีคำแนะนำที่ถูกต้องให้ปฏิบัติตาม ต่อไปนี้คือสิ่งที่ควรมองหาเมื่อค้นหาข้อมูล:
- ปริมาณสินค้าที่ใช้
- ปริมาตรของสารเจือจางที่ใช้
- ประเภทของสารเจือจางที่ใช้ (ปกติคือน้ำ)
- คำแนะนำการผสมพิเศษ
- คุณอาจไม่เห็นข้อมูลเกี่ยวกับความเข้มข้นที่แน่นอนของของเหลวที่ใช้ ข้อมูลนี้ไม่เป็นประโยชน์ต่อผู้บริโภคทั่วไป

ขั้นตอนที่ 2 เติมสารที่ทำหน้าที่เป็นตัวเจือจางลงในสารละลายเข้มข้น
สำหรับการเจือจางในครัวเรือนอย่างง่าย เช่นเดียวกับที่คุณทำในครัว คุณเพียงแค่ต้องรู้ปริมาณความเข้มข้นที่คุณใช้และความเข้มข้นสุดท้ายโดยประมาณที่คุณต้องการก่อนเริ่ม เจือจางสารเข้มข้นด้วยสารเจือจางในปริมาณที่เหมาะสม ซึ่งจะกำหนดขึ้นอยู่กับปริมาตรของความเข้มข้นเริ่มต้นที่ใช้ ดูด้านล่าง:
- ตัวอย่างเช่น หากเราต้องการเจือจางน้ำส้มเข้มข้น 1 ถ้วยตวงเป็น 1/4 ของความเข้มข้นเริ่มต้น เราก็จะเพิ่ม 3 ถ้วย น้ำเข้าเข้มข้น. ส่วนผสมสุดท้ายของเราจะมีความเข้มข้น 1 ถ้วยต่อของเหลวทั้งหมด 4 ถ้วย - 1/4 ของความเข้มข้นเริ่มต้น
- ตัวอย่างที่ซับซ้อนกว่านี้ ถ้าเราต้องการเจือจางความเข้มข้น 2/3 ถ้วยให้เป็น 1/4 ความเข้มข้นเริ่มต้น เราจะเติมน้ำ 2 ถ้วย เพราะ 2/3 ถ้วยเท่ากับ 1/4 คูณ 2&2/3 ถ้วย ของเหลวทั้งหมด
- อย่าลืมเติมสารของคุณในภาชนะที่ใหญ่พอที่จะเก็บปริมาตรสุดท้ายที่คุณต้องการได้ เช่น ชามขนาดใหญ่หรือภาชนะที่คล้ายกัน

ขั้นตอนที่ 3 ละเว้นปริมาณผงในกรณีส่วนใหญ่
การเติมผง (เช่น ส่วนผสมเครื่องดื่มบางชนิด) ลงในของเหลวมักจะไม่ถือว่าเป็นการเจือจาง การเปลี่ยนแปลงของปริมาตรที่เกิดจากการเติมผงจำนวนเล็กน้อยลงในของเหลวมักมีขนาดเล็กจนแทบไม่มีนัยสำคัญ กล่าวอีกนัยหนึ่งเมื่อเติมผงจำนวนเล็กน้อยลงในของเหลว เพียงเพิ่มผงลงในปริมาตรสุดท้ายที่ต้องการของของเหลวและผสม
คำเตือน
- ปฏิบัติตามหลักเกณฑ์ด้านความปลอดภัยที่ผู้ผลิตกำหนดหรือบริษัทของคุณกำหนด นี่เป็นสิ่งสำคัญอย่างยิ่งหากคุณต้องเจือจางสารละลายกรด
- การทำงานกับสารละลายที่เป็นกรดอาจต้องใช้มาตรการและแนวทางความปลอดภัยโดยละเอียดมากกว่าการใช้สารละลายที่ไม่เป็นกรด






